TÓM TẮT
Hydro ở cấp độ phân tử (H2) là một chất chống oxy hóa hiệu quả, khuếch tán nhanh chóng qua màng tế bào, làm giảm các nhóm oxy phản ứng (ROS), như gốc hydroxyl và peroxynitrite, và ngăn chặn tổn thương do oxy hóa gây ra ở một số cơ quan. ROS bị cho là có liên quan đến bức xạ – gây tổn hại đối với phổi. Do việc loại bỏ kịp thời ROS do chiếu xạ nên bảo vệ mô phổi khỏi tác hại của chiếu xạ, chúng tôi đã nghiên cứu khả năng H (2) có thể đóng vai trò như là chất bảo vệ phóng xạ (radioprotector) trong phổi. Các tế bào của dòng tế bào biểu mô phổi của người A549 đã được chiếu xạ 10 Gy có hoặc không có H (2) điều trị thông qua H(2) – giàu PBS hoặc trung bình.
Chúng tôi đã nghiên cứu các tác động phóng xạ có thể có của H (2) bằng cách phân tích ROS và tổn thương tế bào. Ngoài ra, C57BL / 6J chuột cái đã nhận 15 Gy chiếu xạ đến ngực. Các nhóm điều trị hít 3% khí H (2) và tăng cường uống nước H (2). Chúng tôi đã đánh giá tổn thương phổi cấp tính và chiếu xạ muộn sau điều trị H (2). H (2) làm giảm lượng ROS do chiếu xạ trong các tế bào A549, như thể hiện bằng cộng hưởng spin electron và tín hiệu đặc trưng của huỳnh quang. H (2) cũng làm giảm thiệt hại tế bào, được đo bằng mức độ gốc tự do oxy hóa và dấu hiệu apoptotic, và cải thiện khả năng sống của tế bào. Trong vòng 1 tuần sau khi chiếu xạ toàn bộ lồng ngực, hóa mô miễn dịch và mô miễn dịch cho thấy điều trị H (2) làm giảm gốc tự do oxy hóa và gây chết tế bào (apoptosis), các biện pháp gây tổn thương cấp tính, trong phổi của chuột. Vào lúc 5 giờ sau khi chiếu xạ, ngực chụp cắt lớp, điểm số Ashcroft và lắng đọng collagen loại III đã chứng minh rằng điều trị H (2) làm giảm xơ hóa phổi (tổn thương muộn). Do đó, nghiên cứu này đã chứng minh rằng điều trị H (2) có giá trị để bảo vệ chống lại tổn thương phổi do chiếu xạ mà không có độc tính được biết đến.
Chiếu xạ cơ thể thường được sử dụng để điều hòa trước khi ghép tủy xương vì nó có tác dụng ức chế miễn dịch trên hệ thống miễn dịch của vật chủ, giúp giảm thiểu nguy cơ thất bại trong cấy ghép (7). Biến chứng phổi của ghép tủy xương gây ra bệnh tật và tử vong đáng kể. Viêm phổi kẽ, là một tổn thương phổi do bức xạ, có tỷ lệ mắc bệnh được báo cáo là 10-84% sau khi chiếu xạ toàn bộ cơ thể (47). Phổi là một trong những cơ quan dễ bị tổn thương phóng xạ nhất (34) và sự phát triển của viêm phổi kẽ tăng theo liều bức xạ, đặc biệt là chiếu xạ toàn bộ một phần cơ thể với tỷ lệ liều cao hơn (9) và tổng liều phổi cao hơn (3, 37 ).
Bức xạ ion hóa tương tác với các phân tử nước trong các hệ thống sinh học và tạo ra các loại oxy phản ứng (ROS) và các loại nitơ phản ứng (RNS), có thể gây tổn thương tế bào và thậm chí là chết tế bào (41). Ước tính có 60 60% 70% tổn thương tế bào do bức xạ ion hóa được gây ra bởi các gốc hydroxyl (· OH) (36, 46, 51), phản ứng nhanh với các đại phân tử tế bào để làm hỏng DNA, lipid và protein. Phổi là một cơ quan cực kỳ nhạy cảm với tác hại của chiếu xạ (34), và tổn thương phổi do chiếu xạ được báo cáo là bắt đầu và duy trì bởi stress oxy hóa (10, 22, 24). Do đó, loại bỏ kịp thời ROS do chiếu xạ nên bảo vệ mô phổi khỏi tác hại của chiếu xạ. Trên thực tế, ROS đã được ghi nhận để giảm tổn thương phổi do oxy hóa do bức xạ ion hóa (38, 39). Tuy nhiên, không có chất phóng xạ lý tưởng, với hiệu quả, độc tính, chọn lọc và dung nạp mong muốn, vẫn chưa được phát hiện.
Hydro ở cấp độ phân tử (H2) gần đây đã được báo cáo là một chất chống oxy hóa mới và có khả năng được sử dụng rộng rãi trong các ứng dụng y tế là an toàn và hiệu quả mà không có tác dụng phụ được biết đến. H2 cũng sở hữu một số tính chất độc đáo nhất định, như có thể làm dịu chất gây tổn thương ROS, · OH và peroxynitrite (ONOO−), trong khi vẫn bảo tồn phản ứng oxy hóa – chuyển hóa và các chất kém mạnh hơn như hydro peroxide (H 2 O 2) và gốc superoxide ( Ôxy · -) (32). H2 cũng có thể xâm nhập màng tế bào và có thể dễ dàng nhắm mục tiêu các bào quan, bao gồm cả ty thể và hạt nhân (32). Ngoài ra, H2 ức chế tổn thương do oxy hóa gây ra ở một số cơ quan; giảm tổn thương tái thiếu máu cục bộ ở não (32), tim (16), gan (12) và võng mạc (31); và được bảo vệ chống độc tính trên thận (29). Một báo cáo gần đây đã chứng minh rằng điều trị bằng H2 cũng ngăn chặn tổn thương cấp tính do bức xạ trong tế bào lympho và tế bào mật mã đường ruột nhưng không bao gồm phân tích cơ chế phân tử của PBS giàu H2 như một chất tẩy rửa ROS trong ống nghiệm hoặc phân tích sự ức chế, bằng một mũi tiêm trong màng bụng nước muối giàu H2, thiệt hại chiếu xạ muộn ở chuột in vivo (35). Trong nghiên cứu hiện tại, tập trung vào phổi, chúng tôi đã nghiên cứu xem liệu điều trị bằng H2 có gây ra tác dụng bảo vệ phóng xạ hay không, với nghiên cứu đánh giá cơ chế hoạt động của PBS giàu H2 hoặc phương tiện truyền thông như là một phương pháp quét ROS hiệu quả trong ống nghiệm và ức chế cả tổn thương cấp tính và thay đổi fibrotic muộn trong vivo. Phân tích trong ống nghiệm bao gồm sử dụng tín hiệu cộng hưởng spin electron (ESR) và tín hiệu 2 [6 (4′-hydroxy) phenoxy-3H-xanthen-3-on-9-yl] (HPF). Các thí nghiệm in vivo sử dụng hít khí H2 và uống nước giàu H2 khi xử lý H2. Kết quả của chúng tôi chứng minh rằng điều trị bằng H2, như một chất chống oxy hóa, bảo vệ tế bào biểu mô phổi nuôi cấy và phổi của chuột khỏi viêm phổi kẽ do chiếu xạ.
NGUYÊN LIỆU VÀ PHƯƠNG PHÁP
Sản xuất PBS giàu H2 và trung bình.
Để làm PBS của Dulbecco giàu Hydro (Invitrogen, Carlsbad, tiểu bang California) hoặc môi trường nuôi cấy, trong 20 phút, chúng tôi đã tạo bọt H2 trộn với không khí (cả hai ở mức 1 l / phút) đến bão hòa (H2 / không khí: 50/50 vol%) thành 100 ml môi trường RPMI không có màu đỏ PBS hoặc phenol 1640 (Invitrogen) có chứa 1% penicillin-streptomycin. Chúng tôi cũng chuẩn bị kiểm soát PBS giàu N2 hoặc thiếu H2 trung bình bằng cách sủi bọt N2 trộn với không khí (cả hai ở mức 1 l / phút) đến bão hòa (N2 / không khí: 50/50 vol%) vào 100 ml PBS hoặc môi trường trong 20 phút. Chúng tôi đặt PBS hoặc môi trường giàu H2 vào bình nuôi cấy và xác nhận, thông qua thiết bị cảm biến kiểu H2 (Unisense, Aarhus, Đan Mạch), nồng độ H2 hơn 0,3 mM. Mức oxy, được đo bằng O2 kiểu thiết bị cảm biến (Unisense), là khoảng 0,12 mM trong cả hai giải pháp làm giàu H2 và N2. Độ pH, được đo bằng Máy đo nhỏ gọn B-213 (HORIBA, Kyoto, Nhật Bản), nằm trong khoảng từ 7,4 đến 8,0 trong cả hai giải pháp làm giàu bằng H2 và N2.
Nuôi cấy tế bào và xử lý H2.
Các dòng tế bào biểu mô phổi của con người A549 được lấy từ Trung tâm nghiên cứu tế bào nghiên cứu y sinh (Viện phát triển, lão hóa và ung thư, Đại học Tohoku) và được trồng trong các đĩa nuôi cấy hoặc các phiến nuôi cấy với môi trường duy trì chứa 10% FBS và 1% penicillin- streptomycin trong buồng ẩm 5% CO2. Đối với các nghiên cứu phóng xạ, chúng tôi đã loại bỏ các tế bào A549 trung bình, đã xử lý bằng PBS giàu H2 hoặc N2 hoặc môi trường trong các đĩa nuôi cấy hoặc các phiến nuôi cấy trong các thùng chứa kín chứa đầy khí hỗn hợp giàu H2 hoặc N2 như mô tả ở trên, và ngay lập tức tiếp xúc với các tế bào chiếu xạ 10 Gy thông qua máy phát tia X (150 kVp, 5 mA; Hitachi Medical, Tokyo, Nhật Bản).
Xét nghiệm tốc độ máu lắng (ESR) nghiên cứu về xử lý H2 chống phóng xạ.
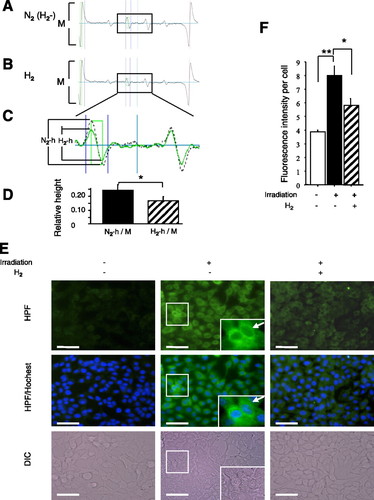
Chúng tôi đã sử dụng 5,5-dimethyl-1-pyrroline N-oxide (DMPO; Labotec, Tokyo, Nhật Bản) để bẫy các gốc tự do, đặc biệt là · OH và phát hiện tín hiệu ESR sau khi chiếu xạ qua máy quang phổ ESR (JES-RE3; JEOL, Tokyo , Nhật Bản). Là một tiêu chuẩn của phản ứng · OH với DMPO, chúng tôi đã tạo ra · OH bằng phản ứng Fenton với hỗn hợp 0,1 mM H 2 O 2 và FeCl2 1 mM với sự hiện diện của 0,1 mM DMPO và thu được các phép đo ESR của dung dịch. Chúng tôi đã bình thường hóa độ nhạy của từng thí nghiệm với cường độ tín hiệu ESR bên trong có nguồn gốc từ Mn2 +, như được hiển thị bởi M trong Hình 1, A và B. Đối với các nghiên cứu phóng xạ, chúng tôi đã chuẩn bị môi trường giàu H2 hoặc N2 trong các đĩa nuôi cấy trong các thùng chứa đậy kín chứa đầy khí như mô tả, thêm 0,1 mM DMPO và ngay lập tức tiếp xúc với mỗi bình đến chiếu xạ 10 Gy. Mười phút sau khi chiếu xạ, chúng tôi đã phát hiện tín hiệu ESR của · OH trong môi trường chiếu xạ bằng cách sử dụng các cuvet phẳng (Labotec). Một phổ khác biệt thu được bằng cách trừ kỹ thuật số một phổ này sang phổ khác để hình dung các tín hiệu giảm bởi H2. Độ cao N2-h và H2-h trong Hình 1C phản ánh cường độ tín hiệu. So sánh các tỷ lệ độ cao của N2-h với M và H2-h với M xuất hiện trong hình 1D (n = 6 thí nghiệm).
Hình 1.
Giảm H2 do chiếu xạ · OH trong môi trường nuôi cấy và tế bào nuôi cấy. A và B: bẫy bẫy 5,5-dimethyl-1-pyrroline N-oxide (DMPO) đã được sử dụng để thu được tín hiệu cộng hưởng spin điện tử (ESR) của gốc DMPO- · OH từ giàu N2 (H2−) (A) hoặc môi trường RPMI giàu H2 (H2 +) (B) trong các thùng chứa đậy kín. M (A, B) là cường độ của tín hiệu ESR bên trong có nguồn gốc từ Mn2 + để chuẩn hóa. C: khung nhìn hợp nhất của các hình chữ nhật màu đen trong A và B. Độ cao của N2-h và H2-h phản ánh cường độ tín hiệu của DMPO- · OH có nguồn gốc từ chiếu xạ · OH. D: so sánh các tỷ số độ cao của N2-h với M và H2-h với M (n = 6 thí nghiệm). E: hình ảnh đại diện của huỳnh quang của các loại oxy phản ứng (· OH và ONOO−) đánh dấu 2- [6- (4′-hydroxy) phenoxy-3H-xanthen-3-on-9-yl] benzoate (HPF) với Hoechst 33342 thuốc nhuộm (đối với hạt nhân) và kính hiển vi tương phản nhiễu (DIC), được chụp 30 phút sau khi chiếu xạ. Hình nhỏ: chế độ xem phóng đại cao của các khu vực trong hình chữ nhật. Mũi tên chỉ ra tín hiệu HPF tăng trong vùng tế bào chất. Thanh tỷ lệ = 50 mm. F: huỳnh quang HPF trong các tế bào được xử lý bằng chiếu xạ 10 Gy trong PBS giàu N2 (H2−) hoặc H2 (H2 +) được định lượng cho 100 tế bào (n = 5). Dữ liệu đại diện cho phương tiện ± SE. * P <0,05 và ** P <0,01.
Phát hiện chiếu xạ gây ra · OH và ONOO− bằng chỉ số huỳnh quang.
Để phát hiện tế bào · OH và ONOO−, sau khi loại bỏ môi trường bảo trì, chúng tôi đã xử lý các tế bào A549 bằng môi trường giàu H2 hoặc giàu N2 và thêm 5 μM HPF (Daiichi Pure Chemicals, Tokyo, Nhật Bản) và thuốc nhuộm 5 μM Hoechst 33342 (Invitrogen ; hạt nhân nhuộm màu xanh lam), sau đó chúng tôi ngay lập tức tiếp xúc với các tế bào chiếu xạ 10 Gy và ủ chúng trong các phiến nuôi cấy trong các thùng chứa kín chứa đầy khí hỗn hợp giàu H2 hoặc N2 như mô tả. Sau 15 phút ủ, chúng tôi thay thế môi trường bằng PBS giàu H2 hoặc giàu N2 cộng với 5 μM HPF và 5 5M Hoechst 33342 và tiếp tục ủ trong 15 phút trong các thùng chứa kín chứa đầy hỗn hợp giàu H2 hoặc giàu N2 khí. Chúng tôi đã hình dung các tín hiệu thông qua bộ lọc cho FITC và 4, 6-diamidino-2-phenylindole (DAPI; Vector Laboratory Laboratory, Burlingame, CA), với kính hiển vi đảo ngược (Eclipse TE2000-E; Nikon, Tokyo, Nhật Bản). Chúng tôi đã thu được hình ảnh bằng cách sử dụng máy ảnh kỹ thuật số và phần mềm MetaMorph (Thiết bị phân tử, Downingtown, PA), với các cài đặt phơi sáng máy ảnh liên tục trong suốt. HPF có thể bị oxy hóa bởi · OH, ONOO− và peroxit lipid nhưng không phải là H 2 O 2, gốc oxit nitric hoặc O2 · – (43). Chúng tôi đã định lượng tín hiệu huỳnh quang cho 100 ô từ mỗi thí nghiệm bằng cách sử dụng hệ thống phân tích hình ảnh (MacScoop phiên bản 2.5; phần mềm Mitani, Fukui, Nhật Bản và NIH Image).
Phát hiện tổn thương tế bào sau khi chiếu xạ.
Vào lúc 36 giờ ủ (30, 40) sau khi chiếu xạ 10 Gy trong các thùng chứa kín chứa đầy khí hỗn hợp giàu H2 hoặc N2, chúng tôi đã đánh giá sự sống sót của tế bào A549 bằng cách đếm thủ công các tế bào, nhuộm hai lần bằng 1 μM propidium iodide ( Invitrogen, hạt nhân của các tế bào chết nhuộm màu hồng) và thuốc nhuộm 5 μM Hoechst 33342 (Invitrogen; hạt nhân của cả tế bào chết và tế bào sống nhuộm màu xanh), trong các bình kín trong môi trường giàu N2 (H2) hoặc giàu H2 (H2 +).
Kháng thể.
Các kháng thể được mua cho phép biến đổi yếu tố tăng trưởng – β 1 (TGF- β 1) và Bax (Công nghệ sinh học Santa Cruz, Santa Cruz, CA), porin (Merck KGaA, Darmstadt, Đức), collagen loại III (SouthernBiotech, Birmingham, AL), hoạt chất caspase 3 (Abcam, Cambridge, MA), caspase 3 (Công nghệ tín hiệu tế bào, Danvers, MA), 4-hydroxy-2-nonenal (4-HNE) và 8-hydroxydeoxyguanosine (8-OH-dG) (Nikken Seil, Tokyo, Nhật Bản) và GAPDH (Epitomics, Burlingame, CA). Kháng thể đơn dòng của chuột chống lại Bcl-xL và Bcl-2 đã được điều chế như mô tả trước đây (27).
Miễn dịch hóa học.
Các tế bào A549 được nuôi cấy trong các phiến nuôi cấy tám giếng (BD Bioscatics, Sparks, MD). Tất cả các thủ tục được thực hiện ở nhiệt độ phòng. Vào 24 giờ ủ (30, 40) sau khi chiếu xạ 10 Gy trong một thùng chứa kín chứa đầy khí hỗn hợp giàu H2 hoặc N2, các tế bào được ủ với MitoTracker Red CMXRos (Invitrogen) trong 15 phút trước khi cố định với 4% paraformaldehyd trong đệm phosphate của Sorensen (0,15 M, pH 7,4; Khoa học kính hiển vi điện tử, Hatfield, PA). Các tế bào được rửa bằng PBS, được thấm trong 10 phút với 0,1% Triton X-100 trong PBS, được rửa bằng PBS và ủ trong 20 phút với dung dịch đệm (huyết thanh dê 5% trong PBS). Các tế bào sau đó được rửa bằng PBS và được ủ bằng kháng thể kháng 8-OH-dG ở mức 5 μg / ml hoặc chống 4-HNE ở mức 25 μg / ml hoặc chống Bax ở mức 2 g / ml-trong 3 giờ, được rửa bằng PBS và ủ trong 1 giờ bằng IgG chống chuột hoặc chống chuột có nhãn FITC (Zymed, San Francisco, CA). Sau khi các mẫu được rửa bằng PBS, các hạt nhân được chống lại bằng DAPI (Vector Laboratory Laboratory). Tín hiệu được hiển thị thông qua bộ lọc cho FITC, với kính hiển vi thẳng đứng (BX60; Olympus, Tokyo, Nhật Bản). Hình ảnh thu được bằng cách sử dụng máy ảnh và phần mềm kỹ thuật số Olympus DP70 (Olympus), với các cài đặt phơi sáng máy ảnh liên tục trong suốt. Tín hiệu huỳnh quang đáp ứng với 8-OH-dG hoặc 4-HNE đã được định lượng cho 100 tế bào từ mỗi thí nghiệm bằng cách sử dụng hệ thống phân tích hình ảnh (phần mềm MacScoop phiên bản 2.5 và NIH Image). Một kính hiển vi quét laser đồng tiêu (TCS-SP5; Leica microsystems, Mannheim, Đức) dựa trên kính hiển vi thẳng đứng (DM6000B; Leica microsystems) được trang bị laser 405 diode / argon / HeNe 543 / HeNe 633 cũng được sử dụng cho hình ảnh dịch Bax .
Việc sử dụng nước giàu Hydro.
H2 được hòa tan trong nước dưới áp suất cao (0,4 MPa) đến mức siêu bão hòa bằng cách sử dụng thiết bị sản xuất nước hydro (phiên bản 2) do Blue Mercury (Tokyo, Nhật Bản) sản xuất. Nước hydro bão hòa được chuẩn bị mỗi tuần và được bảo quản trong túi nhôm có nồng độ hơn 0,6 mM. Mỗi ngày, nước hydro trong túi nhôm được đặt vào một bình thủy tinh kín (70 ml) được trang bị một đường thoát có chứa hai vòng bi, giữ cho nước không bị khử khí. Mạch này đảm bảo nồng độ hydro hơn 0,4 mM sau 1 ngày. Nước hydro khử khí bằng cách khuấy nhẹ được sử dụng cho động vật đối chứng; loại bỏ hoàn toàn khí được xác nhận bằng thiết bị cảm biến kiểu H2 (Unisense).
Mô hình chuột thương tổn phổi chiếu xạ.
Chuột dễ bị xơ hóa (nữ C57BL / 6J, 8 tuần tuổi, trọng lượng cơ thể xấp xỉ 20 g; Dịch vụ phòng thí nghiệm Sankyo, Tokyo, Nhật Bản) đã được sử dụng. Các giao thức động vật đã được phê duyệt bởi Ủy ban Chăm sóc và Sử dụng Động vật của Trường Y khoa Nippon. Những con chuột được nuôi năm con mỗi lồng và được giữ trong điều kiện phòng thí nghiệm tiêu chuẩn, trong đó thức ăn và nước được cung cấp tự do. Chuột được phân phối ngẫu nhiên thành ba nhóm: 1) đối chứng (chiếu xạ sham), 2) chiếu xạ mà không xử lý H2 [với khí N2 hỗn hợp (3% N2 và 97% không khí) và không có nước giàu H2] và 3) chiếu xạ với Xử lý H2 [bằng khí H2 hỗn hợp (3% H2 và 97% không khí) và nước giàu H2]. Toàn bộ phổi của mỗi con chuột được chiếu xạ với liều duy nhất 15 Gy, tia X 150 kVp với tốc độ 0,5 Gy / phút. Dải chì che chắn đầu, bụng và tứ chi. Chuột được gây mê trước khi chiếu xạ bằng cách tiêm natri pentobarbital trong màng bụng (40 mg / kg). Chuột được xử lý bằng khí hỗn hợp (3% H2 và 97% không khí hoặc 3% N2 và 97% không khí) được cung cấp qua máy hóa hơi sử dụng khẩu trang và máy đo lưu lượng khí (H2 hoặc N2: 0,3 l / phút, không khí: 9,7 l / phút) . Nồng độ H2 trong khí hỗn hợp được xác định thông qua sắc ký khí (Model TGA-2000; Teramecs, Kyoto, Nhật Bản). Các nhóm điều trị hít 3% H2 hoặc 3% N2 trong 90 phút trong thời gian chiếu xạ 30 phút và thời gian phục hồi 60 phút và uống nước có hoặc không có nước tự do quảng cáo giàu H2 sau giai đoạn chiếu xạ cho đến khi đánh giá. Các phân nhóm được đánh giá ở 1, 3 và 7 ngày và 5 tháng sau khi chiếu xạ đối với tổn thương phổi chiếu xạ cấp tính và muộn. Vào những ngày được chọn sau khi chiếu xạ, động vật được gây mê và thoát khỏi bằng cách cắt động mạch chủ bụng. Khí quản đã được đóng hộp và phổi đã được cắt bỏ. Phổi trái ngay lập tức được đông lạnh ở −80 ° C và sau đó được sử dụng để phân tích malondialdehyd (MDA) và Western blot. Phổi phải, được sử dụng để phân tích dưới kính hiển vi, được cố định trong 8 giờ ở 4 ° C trong 4% paraformaldehyd trong dung dịch đệm 0,1 M (pH 7,4), với áp suất lạm phát là 20 cm H2O, sau đó chúng được nhúng vào parafin .
Mô học và điểm số xơ hóa.
Các phần nhúng parafin được nhuộm bằng hematoxylin và eosin để kiểm tra mô học thường quy và Massa-Goldner (EMG) để đánh giá sự lắng đọng collagen. Các phần còn lại của phổi phải đã được xử lý cho các nghiên cứu hóa mô miễn dịch. Mức độ nghiêm trọng của xơ phổi được đánh giá thông qua điểm số Ashcroft, như được mô tả trước đây (2). Tóm lại, toàn bộ các trường của 10 phần của phổi phải được quét ở độ phóng đại × 100, và mỗi trường được phân loại trực quan từ 0 (bình thường) đến 8 (tổng độ mờ của trường). Giá trị trung bình của các lớp thu được cho tất cả các lĩnh vực đã được sử dụng làm điểm số xơ hóa thị giác.
Hóa mô miễn dịch.
Các phần phổi của chuột được nhúng paraffin đã bị khử. Để phát hiện collagen loại III, các phần được xử lý với 0,1% pepsin trong 15 phút ở 37 ° C. Sau khi hoạt động peroxidase nội sinh và các vị trí gắn kết không đặc hiệu đã bị chặn thông qua phương pháp Isobe và Brown (4) và sử dụng huyết thanh thỏ bình thường 5% (Phòng thí nghiệm Vector) trong PBS, các phần được ủ qua đêm ở 4 ° C với kháng thể collagen loại III ở một pha loãng 1:40. Sau khi các phần được rửa sạch, chúng được ủ với kháng thể chống dê kết hợp với peroxidase (HRP) [Histofine Simple Stain MAX PO (G); Nichirei Bioscatics, Tokyo, Nhật Bản] trong 1 giờ ở nhiệt độ phòng và được hình dung bằng 3,3-diaminobenzidine tetrahydrochloride (DAB; Dojindo Laboratory Laboratory, Kumamoto, Japan) và H2O2. Để phát hiện 8-OH-dG, các phần được vi sóng trong Giải pháp truy xuất mục tiêu DakoCytomation (Dako, Hamburg, Đức) trong 10 phút ở 100 ° C, sau đó làm lạnh chậm và ba lần rửa trong PBS. Sau khi hoạt động của peroxidase nội sinh bị chặn thông qua phương pháp Isobe và Brown (4), các phần được điều trị bằng Histofine MOUSESTAIN KIT (Nichirei Bioscatics) để ngăn chặn phản ứng của globulin miễn dịch chuột nội sinh trong mô đối với kháng thể thứ hai chống chuột HRP và chúng sau đó được ủ qua đêm ở 4 ° C với kháng thể 8-OH-dG ở mức 5 μg / ml. Sau khi các phần được rửa sạch, chúng được ủ bằng kháng thể chống chuột liên hợp HRP [Histofine Simple Stain MAX PO (M); Nichirei Bioscatics] trong 1 giờ ở nhiệt độ phòng và được hình dung bằng cách sử dụng 3-amino-9-ethylcarbazole (AEC) + nhiễm sắc thể cơ chất (Dako). Kiểm soát âm tính là IgG dê hoặc chuột bình thường; liên kết peroxidase được phát hiện với DAB hoặc AEC (Dako). Các phần được đối chiếu với hematoxylin của Mayer (Merck, Darmstadt, Đức). Tỷ lệ phần trăm diện tích dương tính với collagen loại III trên mỗi trường nhìn được phân tích theo kiểu mù đối với phổi từ mỗi nhóm (n = 6). Số lượng tế bào dương tính 8-OH-dG trên mỗi trường nhìn cũng được đếm và phân tích theo cách tương tự (n = 6). Phương tiện của các giá trị dương được so sánh với các giá trị tương ứng cho mỗi nhóm thông qua hệ thống phân tích hình ảnh (phiên bản MacScoop 2.5).
TUNEL.
Để phân tích tại chỗ phân mảnh DNA, nhuộm deoxynucleotidyl transferase (TdT) dUTP nick cuối (TUNEL) đã được thực hiện với một bộ dụng cụ thương mại (ApopTag Plus Peroxidase trong tình huống Apoptosis Phát hiện Apoptosis hướng dẫn của nhà sản xuất. Tóm lại, các phần phổi nhúng parafin từ chuột bị chiếu xạ đã bị khử chất, sau đó chúng được rửa hai lần bằng PBS và được tiêu hóa bằng proteinase K (20 g / ml) trong 7 phút và peroxidase nội sinh sau đó được làm nguội bằng 3% H2O2 trong 20 phút . Sau hai lần rửa với PBS, các phần được ủ với TdT ở 37 ° C trong 60 phút. Quá trình ủ này được thực hiện bằng cách ủ với thuốc chống digoxigenin-peroxidase trong 60 phút ở nhiệt độ phòng và phát triển màu với H2O2-DAB trong 20 phút, sau đó là ba lần rửa trong nước Milli-Q. Các phần được đối chiếu với hematoxylin của Mayer và được che bằng nắp đậy. Bỏ sót TdT từ bộ đệm ủ trong quá trình xử lý cấu thành kiểm soát tiêu cực kỹ thuật. Số lượng tế bào dương tính với TUNEL trên mỗi trường nhìn được đếm và phân tích theo kiểu mù đối với phổi từ mỗi nhóm (n = 6). Phương tiện của các giá trị dương được so sánh với các giá trị tương ứng cho mỗi nhóm thông qua hệ thống phân tích hình ảnh (phiên bản MacScoop 2.5).
Phân tích Western blot.
Phân tích Western blot được thực hiện theo một quy trình chuẩn cho mỗi thí nghiệm. Định lượng protein được xác định bằng cách sử dụng Bộ xét nghiệm protein BCA (Thermo Science, Rockford, IL). Các tế bào A549 hoặc phổi trái chuột đông lạnh được đồng nhất hóa trong thuốc thử chiết xuất protein động vật có vú chứa một loại cocktail ổn định protein (Halt Protease ức chế cocktail; Thermo khoa học), 150 mM NaCl và 1 mM EDTA. Ty thể được phân lập từ tổng số homogenates phổi bằng cách sử dụng Bộ cách ly Mitochondria cho mô (Thermo khoa học) theo hướng dẫn của nhà sản xuất. Phần ty thể được xác định trên cơ sở biểu hiện cao của porin. Lysates được ly tâm (12.000 vòng / phút, 5 phút) và chất nổi trên bề mặt được gọi là lysates. Lysate chứa lượng protein bằng nhau được đun sôi trong 5 phút trong dung dịch đệm mẫu SDS, được phân tách bằng 10% SDS-PAGE và được chuyển đến màng polyvinylidene Difluoride (Invitrogen) bằng thiết bị đốt điện (Invitrogen). Màng được ủ trong 1 giờ ở nhiệt độ phòng với dung dịch đệm chặn không chứa protein T20 Tris (TBS) không chứa protein (Thermo Science) và sau đó chúng được ủ ở 4 ° C trong ∼16 giờ với kháng thể ở độ pha loãng 1: 1.000 chống lại TGF-1, Bax, Bcl-xL, hoạt động caspase 3, caspase 3, porin hoặc GAPDH. Sau khi màng được rửa nhiều lần bằng TBS chứa 0,1% Tween 20 (TBS-T), chúng được ủ với các kháng thể thứ hai liên hợp HRP (Promega, Madison, WI) trong 45 phút, được rửa bằng TBS-T và được phát triển bằng SuperSignal Giải pháp West Femto Luminol / Enhancer (Thermo khoa học). Khả năng miễn dịch trên blots đã được phát hiện bằng Máy phân tích hình ảnh phát quang LAS-4000 với Camera CCD (Fujifilm, Tokyo, Nhật Bản) và định lượng bằng phương pháp đo mật độ bằng phần mềm Fuji Image đo (phiên bản 4.0; Fujifilm). Sau khi protein được tách ra khỏi màng thấm sau 15 phút ủ trong bộ đệm tước của PLUS PLUS Western Blot (Thermo Science), mỗi protein được định lượng sau phản ứng với các kháng thể thích hợp và được biểu thị bằng tỷ lệ với lượng protein GAPDH. Năm hoặc sáu kết quả tương ứng được báo cáo liên quan đến kết quả tương ứng không có kiểm soát chiếu xạ trong năm hoặc sáu thí nghiệm (không chiếu xạ = 1.0).
Xét nghiệm MDA.
Mức độ MDA tự do, một dấu hiệu của stress oxy hóa, được xác định trong các màng phổi phải được chiếu xạ với sự hiện diện của hydroxytoluene được butyl hóa bằng bộ MDA (BIOXYTECH MDA-586; Oxis International, Foster City, CA). Những con chuột được chiếu xạ có điều trị và kiểm soát giàu N2 (n = 5) hoặc giàu H2 (n = 5) (không chiếu xạ; n = 5) đã được phân tích. Mức MDA miễn phí đã được chuẩn hóa đối với hàm lượng protein trong lysates.
Micro-CT.
Chụp cắt lớp vi tính (micro-CT) của chuột được thực hiện với hệ thống micro-CT LCT-100 (LaTheta; Aloka, Tokyo, Nhật Bản). Cường độ của tia X trong không khí là, 0001.000 đơn vị Hounsfield (HU) và trong nước là 0 HU. Hình ảnh CT được thu được với nguồn tia X bị sai lệch ở mức 50 kVp và 1 mA. Độ dày lát cắt là 0,3 mm. Kích thước hình ảnh là 480 × 480 và trường nhìn là 48 mm ở độ phân giải 0,10 mm mỗi pixel. Các khu vực giữa −400 và HU200 HU được cho là khu vực có mật độ cao bất thường để phân tích trường phổi. Tỷ lệ diện tích mật độ cao bất thường so với toàn bộ trường phổi trong cùng một lát được tính bằng phần mềm hệ thống LCT-100 và được so sánh với chuột không chiếu xạ và chiếu xạ có hoặc không có xử lý H2 (18, 20).
Phân tích thống kê.
Đối với mỗi bộ dữ liệu, các phương tiện số học và sai số chuẩn của các giá trị trung bình đã được tính toán và kiểm tra t của Sinh viên được sử dụng để so sánh các biến độc lập hoặc biến độc lập. Sự khác biệt thống kê giữa các nhóm được xác định bằng cách sử dụng ANOVA một chiều. * P <0,05 và ** P <0,01 được đặt là có ý nghĩa thống kê.
KẾT QUẢ
H2 làm giảm mức độ chiếu xạ · OH trong môi trường và trong tế bào nuôi cấy.
Chúng tôi đã nghiên cứu tác động của H2 lên tín hiệu ESR để xác nhận rằng H2 có thể làm giảm mức độ của các loài gốc tự do, đặc biệt là · OH gây ra bởi chiếu xạ. Chúng tôi đã tạo ra bức xạ gây ra · OH trong môi trường và phân tích · Mức OH bằng cách bẫy quay với DMPO. Các phép đo ESR chỉ ra rằng H2 thực sự đã làm giảm các tín hiệu DMPO-OH có nguồn gốc từ bức xạ gây ra · OH trong môi trường (Hình 1, A D D).
Khi chúng tôi xác nhận rằng H2 làm giảm chiếu xạ · OH trong môi trường nuôi cấy, cũng như đối với · OH được tạo ra bởi phản ứng Fenton (32), tiếp theo chúng tôi đã nghiên cứu xem H2 có thể trung hòa trực tiếp · OH gây ra bởi chiếu xạ trong tế bào sống hay không. Các tế bào A549 được chiếu xạ và được đánh giá huỳnh quang màu xanh lá cây được tạo ra bởi HPF bị oxy hóa (một dấu hiệu oxy hóa của · OH và ONOO−) trong PBS. Sự tiếp xúc của các tế bào với chiếu xạ trong PBS giàu N2 dẫn đến tăng tín hiệu HPF trong các vùng tế bào chất của tế bào (Hình 1E). H2 làm giảm đáng kể tín hiệu HPF với độ thấm đủ của màng tế bào (Hình 1, E và F). Những kết quả này cho thấy H2 có thể làm giảm ROS tế bào (· OH và ONOO−) được tạo ra bởi sự chiếu xạ trong các tế bào biểu mô phổi sống.
H2 bảo vệ các tế bào nuôi cấy khỏi thiệt hại do căng thẳng oxy hóa gây ra bởi chiếu xạ.
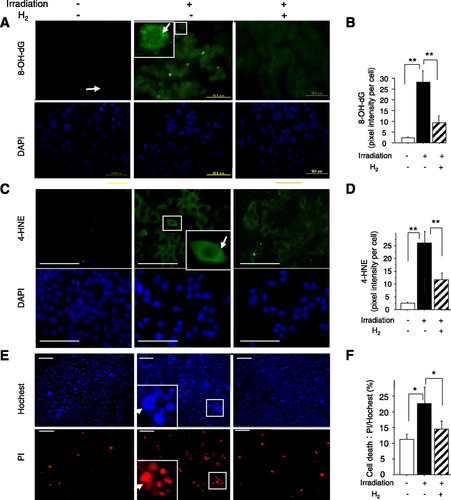
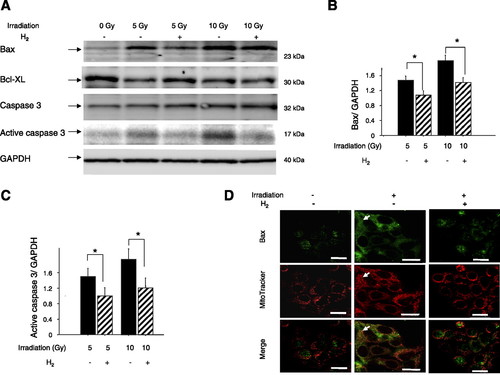
Để tìm hiểu xem H2 có thể bảo vệ hiệu quả các tế bào khỏi tổn thương do oxy hóa gây ra bởi chiếu xạ hay không, chúng tôi đã nghiên cứu mức độ căng thẳng oxy hóa và apoptosis bằng mô hình chiếu xạ trong ống nghiệm. Sau khi môi trường nuôi cấy được thay thế bằng môi trường giàu H2, stress oxy hóa trong các tế bào A549 ngay lập tức được gây ra bởi sự chiếu xạ. Vào lúc 24 giờ sau khi cảm ứng ROS bằng chiếu xạ, H2, với độ thấm đủ vào màng tế bào, dường như bảo vệ tế bào chất khỏi quá trình oxy hóa, như thể hiện bằng cách giảm đáng kể nồng độ 8-OH-dG trong các tế bào được chiếu xạ (Hình 2, A và B) . Hơn nữa, H2 cũng làm giảm đáng kể nồng độ 4-HNE, một sản phẩm cuối cùng của peroxit lipid, trong tế bào chất của các tế bào được chiếu xạ (Hình 2, C và D), chỉ ra rằng nó bảo vệ lipid khỏi peroxid hóa. Phù hợp với những kết quả này và những kết quả khác báo cáo điều chỉnh lại Bax và kích hoạt caspase 3 bằng cách ion hóa chiếu xạ (41), chúng tôi nhận thấy, thông qua phương pháp làm mờ phương Tây, H2 đã làm giảm đáng kể mức độ Bax (Hình 3, A và B) và hoạt động caspase 3 ( Hình 3, A và C) là các dấu hiệu của phản ứng apoptotic trong các tế bào của các tế bào được chiếu xạ sau khi ủ 24 giờ với môi trường giàu H2. Bằng phương pháp hóa mô miễn dịch, chúng tôi đã xác nhận kích hoạt Bax gây ra bởi chiếu xạ và cũng xác nhận việc giảm nó bằng cách xử lý H2, bằng chứng là sự chuyển vị (mũi tên; màu vàng trong hình ảnh hợp nhất của Bax 3D (màu xanh lá cây) từ cytosol ty thể (MitoTracker; màu đỏ) (Hình 3D). Chúng tôi đã phát hiện biểu hiện rõ ràng Bcl-xL trong các ô A549 không có chiếu xạ và giảm mức độ biểu hiện Bcl-xL sau khi chiếu xạ. Điều trị H2 có xu hướng duy trì mức giảm này mặc dù sự khác biệt không khác biệt về mặt thống kê (Hình 3). Chúng tôi cũng xác nhận, bằng cách đếm thủ công các tế bào nhuộm màu bằng kính hiển vi huỳnh quang ở 36 giờ sau khi chiếu xạ, H2 bảo vệ đáng kể khả năng tồn tại của tế bào (Hình 2, E và F).
Hình 2.
Giảm stress oxy hóa gây ra bởi bức xạ và bảo vệ các tế bào nuôi cấy được chiếu xạ bằng H2. Sau khi loại bỏ môi trường bảo trì, các tế bào được ủ trong môi trường giàu N2 (H2−) hoặc giàu H2 (H2 +) trong các thùng chứa đậy kín và ngay lập tức được chiếu xạ 10 Gy. Các tế bào A và C: được duy trì trong môi trường giàu N2 (H2−) hoặc giàu H2 (H2 +) trong 24 giờ trong hộp kín và được miễn dịch bằng kháng thể với 8-hydroxydeoxyguanosine (8-OH-dG) hoặc 4-hydroxy- 2-nonenal (4-HNE). Hình nhỏ: chế độ xem phóng đại cao của các khu vực trong hình chữ nhật. Mũi tên chỉ ra tín hiệu tăng trong vùng tế bào chất. DAPI, 4, 6-diamidino-2-phenylindole. Thanh tỷ lệ = 50 mm. B và D: tín hiệu huỳnh quang đáp ứng với 8-OH-dG hoặc 4-HNE đã được định lượng với 100 tế bào từ mỗi thí nghiệm độc lập (n = 5). E: propidium iodide (PI, tế bào chết) hoặc nhuộm Hoechst 33342 (hạt nhân) của các tế bào được chiếu xạ sau khi ủ 36 giờ trong môi trường giàu N2 (H2−) hoặc giàu H2 (H2 +) trong các thùng chứa kín chứa H2- khí hỗn hợp giàu hoặc giàu N2. Hình nhỏ: chế độ xem phóng đại cao của các khu vực trong hình chữ nhật. Mũi tên chỉ ra các tế bào chết. Thanh tỷ lệ = 50 mm. F: tỷ lệ sống của tế bào, được biểu thị bằng tỷ lệ tế bào dương tính PI / Hoechst, được đánh giá bằng cách đếm thủ công (n = 5). Dữ liệu đại diện cho phương tiện ± SE. * P <0,05 và ** P <0,01.
Hình 3.
Tác dụng của H2 đối với điều chế protein đánh dấu apoptotic trong các tế bào được chiếu xạ. Trả lời: sau khi ủ các tế bào được chiếu xạ 24 giờ (0, 5 hoặc 10 Gy) trong môi trường giàu N2 (H2−) hoặc giàu H2 (H2 +) trong các thùng chứa kín chứa đầy hỗn hợp giàu H2 hoặc giàu N2 khí, chiết xuất tế bào (lysates) đã bị 10% SDS-PAGE và được miễn dịch với các kháng thể chống lại Bax, Bcl-xL, caspase 3, caspase 3 hoạt động và GAPDH (kiểm soát). B và C: trong 5 thí nghiệm tương tự như kết quả xuất hiện trong A, số lượng của mỗi protein được định lượng bằng phép đo mật độ và được biểu thị liên quan đến lượng GAPDH trong cùng một mẫu. Kết quả được báo cáo liên quan đến 5 điều khiển không chiếu xạ trong 5 thí nghiệm (không chiếu xạ = 1.0). Dữ liệu đại diện cho phương tiện ± SE. D: hình ảnh đại diện của huỳnh quang Bax (màu xanh lá cây), MitoTracker (ty thể; màu đỏ) và hình ảnh hợp nhất được chụp trong 24 giờ sau khi chiếu xạ. Mũi tên chỉ ra colocalization (màu vàng) của kết quả dương tính đối với Bax và MitoTracker là sự chuyển vị của ty thể. Thanh tỷ lệ = 20 mm. * P <0,05.
Kết hợp lại với nhau, những phát hiện này cho thấy H2 bảo vệ các tế bào nuôi cấy in vitro chống lại thiệt hại do stress oxy hóa gây ra bởi sự chiếu xạ, bằng chứng là làm giảm phản ứng apoptotic và khả năng sống của tế bào.
H2 bảo vệ chống lại tổn thương phổi do chiếu xạ ở chuột.
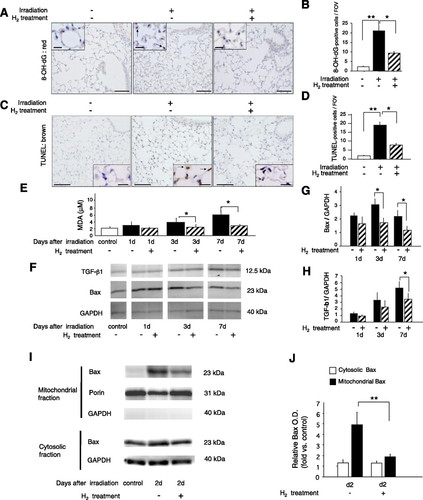
Để kiểm tra khả năng ứng dụng của điều trị H2 in vivo, với H2 đóng vai trò là chất chống oxy hóa, chúng tôi đã sử dụng mô hình chuột bị tổn thương phổi do chiếu xạ để đánh giá hít phải khí H2 trong thời kỳ chiếu xạ và uống nước giàu H2 sau khi chiếu xạ. Trong vòng 1 tuần sau khi chiếu xạ (giai đoạn tổn thương cấp tính), những con chuột được chiếu xạ không được điều trị bằng H2 đã đánh dấu số lượng tế bào phế nang dương tính với nhuộm 8-OH-dG và TUNEL (dấu hiệu của stress oxy hóa và apoptosis, tương ứng), trong khi những con chuột được chiếu xạ bằng phương pháp xử lý H2 được chứng minh là nhuộm ít hơn đáng kể (Hình 4, A D). Phù hợp với những kết quả này, mức độ MDA (một dấu hiệu của peroxid hóa lipid) (Hình 4E) và mức độ Bax, cytokine TGF-prof1 và dịch chuyển ty lạp thể Bax (Hình 4, F tựa J) cũng giảm đáng kể mô phổi từ chuột được chiếu xạ sau khi điều trị H2, khi so sánh với mức độ đối với chuột bị chiếu xạ mà không xử lý H2.
Hình 4.
Giảm tổn thương phổi cấp tính do chiếu xạ ở chuột bằng phương pháp điều trị H2. Chuột cái C57BL / 6J đã nhận được một liều duy nhất 15 Gy vào ngực. Các nhóm điều trị H2 đã hít hỗn hợp 3% H2 và 97% không khí trong thời gian chiếu xạ và phục hồi 90 phút và liên tục uống nước H2 quảng cáo tự do sau khi chiếu xạ cho đến mỗi giai đoạn đánh giá. Các nhóm điều trị không có H2 hít hỗn hợp 3% N2 và 97% không khí trong quá trình chiếu xạ và uống nước không có H2. A và C: vào ngày 1 sau khi chiếu xạ, các phần phổi được nhúng parafin từ mỗi nhóm được nhuộm bằng kháng thể 8-OH-dG (A) hoặc thiết bị đầu cuối gắn nhãn deoxynucleotidyl transferase dUTP (TUNEL) (C). Insets: chế độ xem phóng đại cao. Mũi tên chỉ ra những phát hiện tích cực. Thanh tỷ lệ = 100 m và 15 m cho phần trong (độ phóng đại cao). B và D: số lượng tế bào dương tính với 8-OH-dG hoặc TUNEL, trên mỗi trường nhìn (FOV), được tính trong các khu vực có cùng kích thước từ phổi của mỗi nhóm (n = 6). E: chiết xuất mô phổi từ những con chuột bị chiếu xạ đã điều trị H2 hoặc không điều trị được phân tích về mức độ malondialdehyd tự do (MDA), một dấu hiệu của stress oxy hóa, với sự bình thường hóa thành hàm lượng protein trong chiết xuất. F và I: chiết xuất mô phổi tổng số hoặc chiết xuất mô phổi được phân tách thành các phân số tế bào và ty thể cũng bị SDS-PAGE và được miễn dịch với kháng thể chống lại Bax, biến đổi yếu tố tăng trưởng (TGF) -β1, GAPDH (kiểm soát toàn bộ hoặc tăng trưởng tế bào) và porin (kiểm soát tải ty thể). F: blots đại diện có khoảng trắng cung cấp kiểm soát và kết quả ngày 1 và 3 và 7 có và không có xử lý H2, tương ứng, thu được từ một thí nghiệm làm mờ được thực hiện trong cùng một ngày trong cùng điều kiện. G, H và J: trong 6 thí nghiệm tương tự với kết quả xuất hiện trong F và I, lượng của mỗi protein được định lượng bằng phép đo mật độ và biểu thị liên quan đến lượng GAPDH hoặc porin trong cùng một mẫu. Kết quả được báo cáo liên quan đến 6 điều khiển không chiếu xạ trong 6 thí nghiệm (không chiếu xạ = 1.0). Dữ liệu đại diện cho phương tiện ± SE. * P <0,05 và ** P <0,01.
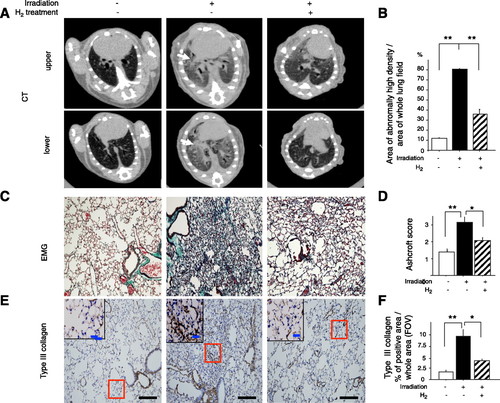
Vào lúc 5 giờ sau khi chiếu xạ (tổn thương muộn), micro-CT ngực cho thấy những con chuột được chiếu xạ có sự gia tăng khu vực về diện tích phóng xạ cho thấy tổn thương phổi, trong khi những con chuột được chiếu xạ đã điều trị bằng H2 cho thấy tổn thương ít hơn đáng kể (Hình 5, A và B). Bằng phương pháp phân tích miễn dịch học, chúng tôi xác nhận rằng chuột bị chiếu xạ đã đánh dấu những thay đổi về u xơ ở vùng phế nang, nhưng chuột được chiếu xạ được điều trị bằng H2 đã chứng minh thiệt hại ít hơn đáng kể, bằng chứng là nhuộm EMG, điểm Ashcroft (Hình 5, C và D) và loại Nhuộm collagen III (Hình 5, E và F). Tất cả những kết quả này chỉ ra rằng điều trị bằng in vivo H2 có thể làm giảm căng thẳng oxy hóa do chiếu xạ và ức chế tổn thương cấp tính và tổn thương xơ phổi tiếp theo ở chuột sau khi chiếu xạ.
Hình 5.
Giảm xơ phổi do chiếu xạ (tổn thương phổi muộn) ở chuột bằng phương pháp điều trị H2. A: phần chụp cắt lớp vi tính (CT) cho thấy vùng ngực giữa (trên) và dưới (dưới) từ chuột kiểm soát và chiếu xạ ở 5 mo sau khi chiếu xạ toàn bộ lồng ngực. Những con chuột được chiếu xạ cho thấy sự gia tăng khu vực trong các tổn thương phóng xạ (mũi tên), nhưng những con chuột được điều trị bằng H2 có mức tăng thấp hơn. B: tỷ lệ của các khu vực có mật độ cao bất thường trên toàn bộ các trường phổi trong cùng một lát đã được tính toán và so sánh với phổi không chiếu xạ và chiếu xạ có hoặc không có xử lý H2 (n = 5). C và E: vào lúc 5 giờ sau khi chiếu xạ, các phần phổi của mỗi nhóm được nhuộm bằng hematoxylin và eosin và thuna Masson-Goldner (EMG) (C) hoặc với kháng thể với collagen loại III (E). Hình nhỏ: chế độ xem phóng đại cao của các khu vực trong hình chữ nhật. Thanh tỷ lệ = 100 m và 20 m cho phần trong (độ phóng đại cao). D và F: mức độ nghiêm trọng của xơ phổi được đánh giá với điểm số Ashcroft (D) và các khu vực dương tính với collagen III (F) trên FOV được phân tích cho các khu vực có cùng kích thước từ phổi của mỗi nhóm (n = 6). Dữ liệu đại diện cho phương tiện ± SE. * P <0,05 và ** P <0,01.
THẢO LUẬN
Trong nghiên cứu hiện tại, chúng tôi đã nghiên cứu xem liệu điều trị bằng H2 có gây ra tác dụng phóng xạ trên phổi hay không. Chúng tôi đã chứng minh rằng là một chất chống oxy hóa, H2 có thể bảo vệ các tế bào biểu mô phổi nuôi cấy và phổi của chuột khỏi tổn thương chiếu xạ (viêm phổi kẽ).
Các tác động có hại của bức xạ ion hóa đã được công nhận là kết quả của cả hai cơ chế trực tiếp và gián tiếp. Hành động trực tiếp làm hỏng các phân tử nhạy cảm trong các tế bào, trong khi các hành động gián tiếp xảy ra khi bức xạ ion hóa tương tác với các phân tử nước trong tế bào, dẫn đến việc tạo ra các gốc tự do phản ứng như · OH, ONOO−, O2 · – và H2O2. Thời gian bán hủy của các gốc tự do này cực kỳ ngắn; tuy nhiên, chúng phản ứng ngay lập tức với các phân tử sinh học gần đó, tạo ra tổn thương oxy hóa đặc hiệu tại chỗ, có thể phá vỡ chức năng tế bào và có thể giết chết các tế bào. · OH và ONOO− là các sản phẩm phản ứng cao của ROS được tạo ra trong các tế bào; chúng phản ứng nhanh với các đại phân tử tế bào để làm hỏng DNA, lipid và protein và gây ra tác dụng gây độc tế bào mạnh. · OH đã được ước tính gây ra 60 tổn 70% 70% tổn thương tế bào do bức xạ ion hóa (36, 46, 51).
Các nghiên cứu gần đây đã chứng minh rằng H2 giảm · OH và ONOO− và có thể có tiềm năng sử dụng rộng rãi trong các ứng dụng y tế như một chất chống oxy hóa mới, an toàn, hiệu quả với các tác dụng phụ tối thiểu (12, 16, 29, 31, 32, 35). Loại bỏ · OH rất quan trọng về mặt sinh học, bởi vì mặc dù O2 · – và H 2 O 2 được khử độc bằng các enzyme bảo vệ chống oxy hóa superoxide effutase (SOD) (O2 · -) và peroxidase hoặc glutathione peroxidase (H 2 O 2), nhưng không có enzyme nào khử độc. Bởi vì · OH và ONOO− là ROS gây tổn thương và tạo ra hầu hết các thiệt hại cấp tính do bức xạ ion hóa (36, 46, 51), chúng tôi đã đưa ra giả thuyết rằng việc xử lý H2 có thể là bảo vệ phóng xạ do hậu quả của việc loại bỏ ROS.
Trong nghiên cứu này, chúng tôi đã phát hiện thành công, thông qua ESR, chiếu xạ · OH và chúng tôi đã giảm mức tín hiệu của nó bằng cách sử dụng H2 (Hình 1, A D). Chúng tôi cũng nhận thấy rằng sự tích lũy tăng cường chiếu xạ ROS (· OH và ONOO−), bằng chứng là tín hiệu HPF trong các tế bào và H2 đã làm giảm hiệu ứng chiếu xạ này (Hình 1, E và F). Những kết quả này phù hợp với một báo cáo trước đó trong đó H2 làm giảm cả tín hiệu · DMPO-OH có nguồn gốc từ · OH được tạo ra bởi phản ứng Fenton của tế bào và tín hiệu HPF là · OH trong các tế bào sống sau khi cảm ứng bởi chất ức chế phức hợp hô hấp III (32) ). Mặc dù · OH phản ứng nhanh chóng với các đại phân tử tế bào làm hỏng DNA, lipid và protein, nhưng chúng tôi thực sự đã thu được bằng chứng trực tiếp rằng phương pháp điều trị H2 của chúng tôi đã loại bỏ · OH được tạo ra bởi chiếu xạ trong ống nghiệm cũng như · OH được tạo ra bởi phản ứng Fenton của tế bào trong ống nghiệm (32) .
Trong quá trình điều chỉnh phản ứng apoptotic, các tế bào động vật có vú sử dụng các protein thuận từ họ Bcl-2 để đối kháng với chức năng proapoptotic của Bax (42). Sự chuyển vị Bax từ cytosol sang ty thể là một bước quan trọng trong việc kích hoạt tín hiệu tử vong (50), dẫn đến giải phóng cytochrom c và kích hoạt caspase 9, sau đó kích hoạt caspase 3 (42). Hoạt hóa Caspase 3 rất cần thiết cho sự phân cắt của enzyme sửa chữa enzyme poly (ADP-ribose) polymerase, dẫn đến sự phân mảnh DNA bộ gen như một phản ứng apoptotic. Upregulation của Bax và kích hoạt caspase 3 được báo cáo gây ra bằng cách chiếu xạ ion hóa như là các dấu hiệu của một phản ứng apoptotic (41, 50).
Trong các nghiên cứu được báo cáo ở đây, chúng tôi đã chỉ ra rằng H2 đã ngăn chặn hiệu quả sự chết tế bào, như đã thấy với nhuộm propidium iodide / Hoechst (Hình 2, E và F), bằng cách giảm các sự kiện apoptotic, chẳng hạn như điều hòa Bax liên quan đến chuyển vị từ cytosol sang ty thể và kích hoạt caspase 3 (Hình 3), thông qua việc duy trì trạng thái oxy hóa tế bào như thể hiện ở mức 8-OH-dG (oxy hóa DNA) và 4-HNE (peroxid hóa lipid) (Hình 2, A D). Rõ ràng sự ức chế thiệt hại chỉ ra rằng H2 ngăn chặn sự suy giảm trạng thái năng lượng sinh học của các tế bào gây ra bởi sự chiếu xạ trong ống nghiệm. Những phát hiện này phù hợp với một báo cáo về sự ức chế apoptosis gây ra bởi bức xạ trong các tế bào Molt-4 của con người bởi các chất chống oxy hóa như N-acetyl-l-cysteine và Trolox (6-hydroxy-2,5,7,8-tetramethylchroman-2- axit cacboxylic, một dẫn xuất tan trong nước của vitamin E) (30). Do đó, dữ liệu từ nghiên cứu của chúng tôi cho thấy H2 có thể quét sạch ROS và bảo vệ chống lại thiệt hại apoptotic liên quan đến stress oxy hóa gây ra bởi chiếu xạ trong ống nghiệm.
Tổn thương phổi do bức xạ được đặc trưng bởi một giai đoạn viêm phổi cấp tính, sau đó là giai đoạn xơ hóa phát triển nhiều tháng hoặc nhiều năm sau khi chiếu xạ (25). Các nghiên cứu trước đây ủng hộ ý kiến cho rằng stress oxy hóa bắt đầu và duy trì tổn thương phổi do bức xạ trong cơ thể (10, 22, 24). Ngoài việc tạo ra một đợt bùng phát nhanh chóng trong thời gian ngắn của ROS tại thời điểm chiếu xạ, kích thích các hệ thống tạo ra ROS cục bộ, như NADPH oxyase, xanthine oxyase, nitric oxide synthase (NOS) và chuỗi hô hấp của ty thể bị rối loạn chức năng tác động gây ra sự phát triển của tổn thương phổi do bức xạ mãn tính do sự dư thừa của ROS như H 2 O 2, O2 · -, ONOO− và · OH (10, 21 Chuyện24, 26). Trên thực tế, ROS trực tiếp hoặc gián tiếp điều chỉnh một số yếu tố phiên mã (như yếu tố hạt nhân-κB và yếu tố thiếu oxy-cảm ứng-1α) và các sản phẩm hạ nguồn của chúng (như TGF-và yếu tố tăng trưởng nội mô mạch máu) (23). Do đó, cả sự bùng nổ ngắn ngủi của ROS và nồng độ ROS cục bộ được duy trì đều có vai trò nguyên nhân gây tổn thương phổi do bức xạ cấp tính và muộn và do đó là những mục tiêu cực kỳ quan trọng trong việc bảo vệ khỏi stress oxy hóa do chiếu xạ in vivo.
Dữ liệu in vitro của chúng tôi cho thấy rằng xử lý H2 có thể quét sạch ROS và bảo vệ chống lại thiệt hại apoptotic liên quan đến stress oxy hóa gây ra bởi chiếu xạ, nhưng điều trị H2 không hoàn toàn quét sạch ROS và không thể bảo vệ hoàn toàn chống lại thiệt hại apoptotic gây ra bởi chiếu xạ (Figs. 1 .3) . Do đó, trong nghiên cứu in vivo của chúng tôi được báo cáo ở đây, chúng tôi đã sử dụng hít khí H2 trong quá trình chiếu xạ để bảo vệ chống lại sự bùng nổ của ROS trong thời gian ngắn gây ra thiệt hại cấp tính, cũng như tiếp cận liên tục với nước uống giàu H2, đến mức thiệt hại muộn giai đoạn, để bảo vệ chống lại thiệt hại oxy hóa tiếp tục từ nồng độ ROS cục bộ duy trì. Thiết kế điều trị này dựa trên cơ chế sinh lý bệnh học cụ thể của tổn thương muộn phổi do chiếu xạ in vivo. Chúng tôi thấy rằng điều trị H2 thực sự là phóng xạ không chỉ in vitro mà còn in vivo.
Điều trị H2 làm giảm đáng kể mức độ nghiêm trọng của tổn thương oxy hóa do bức xạ ion hóa và phản ứng apoptotic trong phổi chuột, bằng chứng là mức độ dịch chuyển của MDA, 8-OH-dG, TUNEL, Bax và Bax, và giảm biểu hiện TGF-1 (Hình 4) trong giai đoạn thiệt hại cấp tính. Những kết quả này tương tự như những phát hiện trước đây về bảo vệ não, tim và gan khỏi tổn thương do stress oxy hóa cấp tính bằng cách hít khí H2 1%, có nồng độ trong máu được ước tính là 8 μM (12, 16, 32). Sự bảo vệ này có thể chủ yếu là do ROS (· OH và ONOO−) nhặt rác bằng H2, như kết quả trong ống nghiệm của chúng tôi đề xuất.
Chúng tôi cũng xác định, bằng phương pháp micro-CT ngực và phát hiện bệnh lý, rằng tác dụng bảo vệ phóng xạ trong điều trị H2 của chúng tôi, được phản ánh bằng cách ức chế xơ phổi, rõ ràng là 5 tháng sau khi tiếp xúc với chiếu xạ, trong giai đoạn muộn của tổn thương (Hình. 5). Một nghiên cứu về mô hình gây độc thận ở chuột báo cáo rằng H2 được phát hiện trong máu sau khi chuột uống nước có chứa H2 đạt nồng độ vài μM trong 3 phút và dẫn đến giảm stress oxy hóa (29). Do đó, việc tiếp xúc với H2 liên tục bằng cách uống nước giàu H2 có thể duy trì, thông qua lưu thông máu, bảo vệ chống lại tình trạng oxy hóa duy trì của phổi bị chiếu xạ, mặc dù H2 thu được bằng cách uống nước giàu H2 được cho là giữ lại trong một thời gian tương đối ngắn và ở nồng độ thấp. Do H2 hết hạn qua phổi, một cơ quan trao đổi chất có lưu lượng máu phổi lớn và H2 có thể lan nhanh vào các tế bào trong phổi do cấu trúc giải phẫu của phổi lỏng lẻo, H2 có thể dễ dàng đến các tế bào phổi. Các nghiên cứu khác đã báo cáo kết quả tương tự như chúng tôi, rằng uống nước giàu H2 liên tục có thể bảo vệ chống lại tổn thương oxy hóa kéo dài, chẳng hạn như xơ vữa động mạch ở chuột bị loại bỏ apolipoprotein E trong điều trị 6 tháng (33), cho thấy căng thẳng oxy hóa ở bệnh nhân tiểu đường. Điều trị 8 tuần (19), tổn thương thận do cisplatin gây ra ở chuột trong điều trị 10 ngày (29) và bệnh thận do allograft mãn tính ở chuột để điều trị 5 tháng (6). Kết quả của chúng tôi để bảo vệ trong giai đoạn cuối của thiệt hại chiếu xạ có thể một phần do hiệu quả bảo vệ của việc nhặt rác ROS (· OH và ONOO−) trong giai đoạn thiệt hại cấp tính đạt được bằng cách hít H2 và một phần từ tác dụng bảo vệ của ROS thu được bằng cách uống nước giàu H2 trong giai đoạn phá hủy muộn, liên quan đến stress oxy hóa cục bộ kéo dài từ ROS tương đối phản ứng như H 2 O 2, O2 · – và ONOO−.
ONOO -1, được đánh giá bởi sản xuất nitrotyrosine, được báo cáo là một ROS địa phương, được hình thành từ O2 · – và NO, sản xuất được duy trì trong tổn thương do chiếu xạ của phổi và tuyến nước bọt; ức chế NOS đã ngăn chặn các tổn thương do chiếu xạ (13, 15, 44). Bởi vì H2 cũng làm giảm ONOO−, chúng tôi đề nghị rằng việc xử lý H2 bao gồm uống nước giàu H2 cũng có thể có tác dụng bảo vệ ONOO trong các giai đoạn thiệt hại muộn trong mô hình chiếu xạ của chúng tôi ngoài các giai đoạn thiệt hại cấp tính.
Một số báo cáo chỉ ra rằng H2O2 và O2 · – đóng vai trò quan trọng trong quá trình tổn thương phổi do phóng xạ khi một đợt bùng phát ngắn của ROS và duy trì ROS cục bộ, với bằng chứng về hiệu quả bảo vệ bằng cách sử dụng một số phương pháp điều trị liên quan đến SOD ( 1, 24). Uống nước giàu H2 gần đây đã được báo cáo là có tác dụng bảo vệ thông qua việc giảm căng thẳng oxy hóa liên quan đến điều hòa hoạt động SOD, ví dụ, ở những đối tượng mắc hội chứng chuyển hóa sau 8 tuần điều trị H2 (28) và ở chuột SAMP8 dễ bị lão hóa , có tình trạng căng thẳng oxy hóa cao hơn với rối loạn chức năng ty thể, sau 18 tuần điều trị H2 (14). Do đó, các cơ chế chính xác về tác dụng bảo vệ của việc uống nước giàu H2 vẫn đang được nghiên cứu. Tuy nhiên, chúng tôi đề nghị rằng uống nước giàu H2 có thể có tác dụng bảo vệ chống lại H2O2 và O2 · – trong giai đoạn thiệt hại muộn trong mô hình của chúng tôi thông qua hoạt động SOD được điều chỉnh.
Một loạt các chất chống oxy hóa, bao gồm các hợp chất thiol và chất chống oxy hóa tự nhiên và chiết xuất, được báo cáo là bảo vệ chống độc tính phóng xạ (45, 49). Các hợp chất thiol là các chất phóng xạ được nghiên cứu lâu nhất và hiệu quả nhất. Thiol amifostine tổng hợp là chất bảo vệ phóng xạ duy nhất được Cục quản lý dược phẩm và thực phẩm Hoa Kỳ phê duyệt hiện nay (8). Tuy nhiên, nó có những điểm yếu nghiêm trọng, như độc tính tương đối cao, đường dùng không thuận lợi và thời gian bảo vệ ngắn (17). Các chất chống oxy hóa tự nhiên, chẳng hạn như vitamin E, melatonin, flavonoid và các chất khác, có ít tác dụng phụ độc hại hơn nhưng cũng cung cấp sự bảo vệ ít hơn so với các tác nhân thiol (17, 48).
So với các chất chống oxy hóa này, H2 có lợi thế là bảo vệ các tế bào mà không ảnh hưởng rõ ràng đến O2 · – và H 2 O 2, có vai trò sinh lý quan trọng. Nếu lấy quá nhiều H2, lượng dư sẽ bị hết qua phổi. Trên thực tế, H2 đã được sử dụng cho con người, để ngăn ngừa bệnh suy giảm ở thợ lặn, ở mức áp suất một phần 2 MPa của H2, điều này cho thấy rằng 16 mM H2 trong máu có thể là mức an toàn (11). Các nghiên cứu trước đây đã báo cáo rằng, trong các trường hợp căng thẳng oxy hóa cấp tính và nghiêm trọng do tái tưới máu thiếu máu cục bộ, khí H2 1% là đủ để bảo vệ, mà không ảnh hưởng đến các đặc điểm sinh lý như nhiệt độ cơ thể, huyết áp, pH và Po2 máu (5, 12, 16, 32). Ngoài việc hít khí H2, uống nước giàu H2 sẽ bảo vệ chống lại thiệt hại oxy hóa tiếp tục, như đã đề cập trước đó (19). Tất nhiên, uống nước giàu H2 như một phương pháp xử lý H2 có một lợi thế là thuận tiện.
Do đó, trong nghiên cứu của chúng tôi, H2, được cung cấp khi bắt đầu chiếu xạ bằng cách hít khí H2 và trong giai đoạn sau khi chiếu xạ bằng cách uống nước giàu H2, có thể có ảnh hưởng trực tiếp và gián tiếp như bảo vệ chống lại trạng thái oxy hóa của phổi và có thể dẫn đến ức chế xơ hóa do chiếu xạ. Mặc dù dữ liệu của chúng tôi không thể phân tách tác động của việc hít khí H2 và uống nước giàu H2, chúng tôi có thể cung cấp bằng chứng về tác dụng phóng xạ của điều trị H2 chống lại tổn thương phổi do bức xạ cấp tính và muộn trong vivo, mà chúng tôi tin là báo cáo đầu tiên bằng chứng như vậy.
Kết luận, chúng tôi đã chỉ ra rằng H2, không có tác dụng phụ độc hại đã biết, bảo vệ hiệu quả các tế bào và phổi của chuột khỏi stress oxy hóa và thiệt hại do chiếu xạ do sự khuếch tán nhanh chóng của H2 qua màng tế bào và phản ứng của nó với ROS gây độc tế bào. Do đó, việc phát triển các phương pháp chống oxy hóa liên quan đến H2 để điều trị tổn thương phổi do chiếu xạ có thể là có thể và cũng có thể bảo vệ chống lại viêm phổi kẽ do chiếu xạ.
TÀI TRỢ
Nghiên cứu này được tài trợ bởi Viện trợ cho nghiên cứu khoa học từ Bộ Giáo dục, Văn hóa, Thể thao, Khoa học và Công nghệ (MEXT) của Nhật Bản. Nghiên cứu này cũng được hỗ trợ một phần bởi một khoản tài trợ cho Nhóm nghiên cứu bệnh phổi khuếch tán từ Bộ Y tế, Lao động và Phúc lợi Nhật Bản.
TIẾT LỘ
Không có xung đột lợi ích, tài chính hoặc mặt khác, được tuyên bố bởi các tác giả.
LỜI CẢM ƠN
Các tác giả cảm ơn cô Judith B. Gandy vì đã chỉnh sửa bản thảo xuất sắc.
GHI CHÚ TÁC GIẢ
Địa chỉ cho các yêu cầu in lại và thư từ khác: Y. Terasaki, Khoa Phân tích Bệnh lý học ở người, Trường Cao học Y khoa, Trường Y khoa Nippon, 1-1-5 Sendagi, Bunkyo-ku, Tokyo 113-8602, Nhật Bản (e-mail: terasaki@nms.ac.jp).
***********************************
Thông tin về IZUMIO
HYDRO CÓ TRONG IZUMIO LÊN ĐẾN 2,6 TRIỆU PPT ( 2.6PPM). Hàm lượng khí Hydro cao nhất trên thị trường nước hydro hóa. Là sản phẩm hiện bán chạy số 1 tại Nhật Bản và một số quốc gia khác.